L'énergie chimique
I - D'où provient l'énergie chimique ?
⇨ L'énergie chimique sert à établir des liaisons entre les atomes d'une molécule.
⇨ Au cours d'une transformation chimique ces liaisons sont rompues et d'autres se forment. Globalement, il peut se produire trois situations : la transformation chimique libère de l'énergie, on dit qu'elle est dite exothermique ; la transformation chimique consomme de l'énergie, on dit qu'elle est endothermique ; et il reste le cas où la transformation chimique ne consomme ni ne libère d'énergie, on dit qu'elle est athermique.
II - Diagramme d'énergie associé à une transformation chimique
La combustion du méthane produit de la chaleur (énergie thermique). On peut établir cela à partir d'un bilan d'énergie prenant en compte chaque liaison rompue ou formée lors de la transformation chimique. Prenons le cas de la combustion d'une molécule de méthane :
\[ { CH_4 + 2\text{ } O_2 \rightarrow CO_2 + 2\text{ } H_2O } \]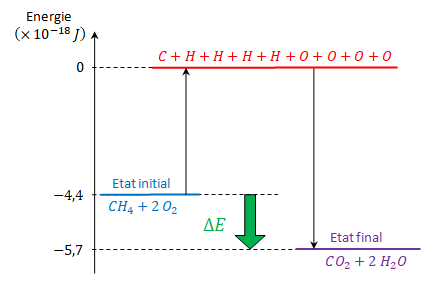
Remarque. Une combustion est une transformation exothermique. Elle libère toujours de l'énergie. La flèche verte dans le diagramme d'énergie est toujours orientée vers le bas : \(ΔE<0\).
Démo :
\(E_{initiale}=E_{finale}+E_{produite}\)
Si la réaction est exothermique alors \(E_{produite}>0\)
Or \(E_{produite}=E_{initiale}-E_{finale}=-ΔE\)
Donc \(ΔE<0\)
⇨ L'énergie libérée par la combustion d'une mole de combustible vaut alors :
\[ΔE_{mole}=ΔE \times N_A\]où \(N_A=6,02×10^{23}\) est le nombre d'Avogradro ; c'est-à-dire le nombre de molécules dans une mole.
⇨ En connaissant la masse molaire \(M\) du combustible, on peut connaître l'énergie libérée par la combustion d'un gramme de combustible :
\[ΔE_{g}=\dfrac{ΔE_{mole}}{M}\]et pour \(1 \text{ } kg\) :
\[ΔE_{kg}=1000 \times \dfrac{ΔE_{mole}}{M}\]III - Le pouvoir calorifique d'un combustible
Le pourvoir colorifique est l'énergie libérée par la combustion d'un kilogramme de combustible. Il est noté \(PC\) :
\[ \bbox[yellow, 4px, border:1px solid red] { PC=\dfrac{ΔE_{chimique}}{m_{combustible}} } \]Remarque. Si \(m_{combustible}=1 \text{ } kg\) alors \(ΔE_{combustible}=PC\) est le pouvoir calorifique massique du combustible.
⇨ Voici un lien pour quelques valeurs de \(PC\).





